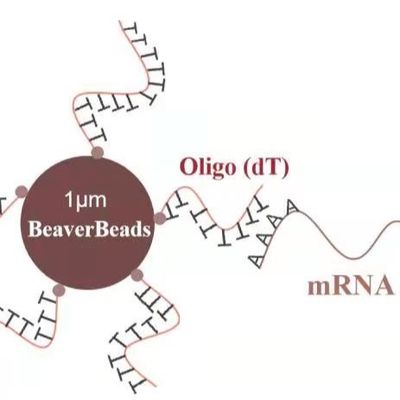
IVD 키트 개발: 진단 워크플로우에 실리카 자성 비드 통합
SEO 키워드:IVD 분석 개발, 실리카 자성 비드, 핵산 정제 키트, 임상 진단, 자동화된 워크플로우 통합, 시약 제조.
IVD에서 원자재 선택의 전략적 중요성
진단 키트 제조업체에게 "연구 개발" 단계는 시작에 불과합니다. 분자 분석을 벤치탑에서 상업적으로 실행 가능한 체외 진단(IVD) 제품으로 옮기려면 구성 요소의 안정성과 확장성에 대한 깊은 이해가 필요합니다. 모든 구성 요소 중에서 실리카 자성 비드는 입력 샘플의 순도를 보장하는 데 가장 중요하다고 할 수 있습니다. 이 기사에서는 이러한 비드를 표준화된 진단 워크플로우에 통합하기 위한 기술적 및 전략적 고려 사항을 살펴봅니다.
일관성: 진단 제조의 북극성
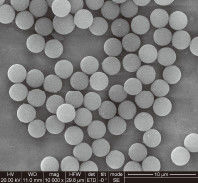
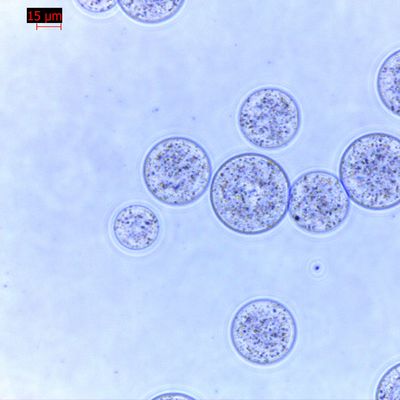
IVD 회사가 연간 수백만 건의 테스트로 생산 규모를 확장할 때 "변동성"은 적이 됩니다. 비드의 표면적이나 자기 반응의 약간의 변화는 일관되지 않은 검출 한계(LoD) 값으로 이어질 수 있습니다.
-
표면 전하 밀도: 엔지니어는 비드 표면의 실라놀 그룹 밀도가 서로 다른 로트에서 일정하게 유지되도록 해야 합니다. 이는 DNA/RNA의 결합 효율에 직접적인 영향을 미칩니다.
-
초상자성 및 재현탁: 고처리량 임상 환경에서 비드는 결합 단계 동안 현탁 상태를 유지해야 하지만 자석이 적용되면 즉시 응집됩니다. 어떤 "덩어리짐" 또는 잔류 자성도 비드 캐리오버로 이어질 수 있으며, 이는 다운스트림 qPCR 또는 NGS 효소를 억제합니다.
수동 및 자동화된 워크플로우 간의 격차 해소
대부분의 IVD 분석은 "자동화 준비"를 위해 설계되었습니다. 즉, 실리카 자성 비드는 액체 처리 플랫폼(예: Hamilton, Tecan 또는 KingFisher)과 호환되어야 합니다.
-
피펫팅 가능성: 비드는 좁은 피펫 팁을 막지 않는 크기(일반적으로 1~3 $mu m$)여야 합니다.
-
프로토콜 표준화: 잘 설계된 실리카 비드를 사용하면 모든 개방형 시스템 로봇 워크스테이션에 프로그래밍할 수 있는 범용 프로토콜(용해, 결합, 세척 및 용출)을 사용할 수 있습니다.
-
데드 볼륨 최적화: 고가 시약의 경우 반응당 필요한 비드 부피를 최소화하는 것이 테스트당 경쟁력 있는 가격을 유지하는 데 필수적입니다.
규제 및 품질 보증 요구 사항
조달 및 품질 관리(QC) 팀의 경우 실리카 자성 비드 소싱은 규정 준수의 문제입니다.
-
ISO 13485 표준: 공급업체는 의료 기기 제조와 일치하는 품질 관리 시스템을 입증해야 합니다.
-
추적성: 모든 비드 배치는 원자재($Fe_3O_4$ 및 실리카 전구체)로 추적할 수 있어야 합니다.
-
유통 기한 안정성: 다양한 완충 조건에서 보관할 때 비드가 12~24개월 동안 기능적으로 유지됨을 증명하기 위해 가속 노화 연구가 필요합니다.
사내 vs. 아웃소싱 비드의 경제성
의사 결정자는 종종 "구매 vs. 제조"의 장단점을 비교합니다. 대형 진단 대기업은 자체 비드를 합성하려고 시도할 수 있지만, 대부분의 중소형 IVD 업체는 전문 제조업체에 아웃소싱하는 것이 위험을 줄인다는 것을 알게 됩니다. 아웃소싱은 악명 높은 PCR 억제제인 철 이온의 침출을 방지하는 독점 코팅 기술에 대한 접근을 제공합니다.
결론: 분석의 미래 보장
업계가 2026년 이후로 나아가면서 초점은 더 빠른 "샘플-결과" 시간으로 이동하고 있습니다. 고성능 실리카 자성 비드는 시간 소모적인 정제 단계를 줄이는 핵심이며, 이를 통해 진단 회사는 임상 시장에 더 빠르고 더 신뢰할 수 있는 키트를 제공할 수 있습니다.

 귀하의 메시지는 20-3,000 자 사이 여야합니다!
귀하의 메시지는 20-3,000 자 사이 여야합니다! 이메일을 확인하십시오!
이메일을 확인하십시오!  귀하의 메시지는 20-3,000 자 사이 여야합니다!
귀하의 메시지는 20-3,000 자 사이 여야합니다! 이메일을 확인하십시오!
이메일을 확인하십시오!